- + Merck Millipore
- + Thermo Fisher
- + IKA
- + 顯微鏡
- + 光度計
- + 成像系統
- + MACS Miltenyi
- + 均質機
- + 粒子計數器
- + 凍干機
- + 滅菌系統
- + 細胞
- + 微量移液工作站
- + 振蕩培養箱
- + 生物反應器
- + 切片機
- + 培養箱
- + 蠕動泵
- + 細胞破(粉)碎機
- + 轉印膜
- + 超濾管
- + Pellicon 超濾系統
- + 超低溫冰箱
- + 清洗機
- + 干燥機
- + 洗瓶機
- + 離心泵
- + 容積泵
- + 各種閥
- + 酶標儀
- + 洗衣板
- + 旋光儀
- + 折光儀
- + 行星球磨機
- + 振動篩
- + 基因導入儀
- + 手套系列
- + 接頭\\連接器
- + 培養板/培養瓶
- + 溫度控制系統
- + 制冷器
- + 存取系統
- + 軋蓋機
- + 細胞因子
- + 細胞分選儀
- + 生物安全柜
- + 滲透壓儀
- + 拉曼光譜儀
- + 電泳系統
- + 純水系統
- + 萃取儀
- + 譜新生物
- + TA 儀器
- + wako
干貨 || 關于原料和制劑穩定性試驗的名詞解釋
更新時間:2020-06-08 瀏覽次數:3869
寫在前面
在過去的30年里,藥物的穩定性實驗已從僅僅檢測產品中有害物質的變化發展到運用科學原理對藥品進行綜合性的質量控制。目前,世界各國對此項工作逐漸重視,各國都已開始制定適合本國的藥品穩定性實驗規范。由于穩定性研究周期較長,因此從建立方案時就應對產品詳盡分析,還應考慮協調指南(ICH指南)、歐洲藥物審評機構要求和美國FDA穩定性實驗要求等。按照這些指南或要求所獲得的穩定性數據將有利于藥品的化注冊。


今天這篇文章,將為大家帶來有關“穩定性試驗”的一些名詞解釋,全篇干貨,建議直接收藏噢~
藥物的穩定性:在特定的容器或密閉系統中可保持藥物原有的物理、化學、生物學、治療、毒理及其相關性能。理想的情況是藥物原料的純度、雜質含量在各個安全性實驗、臨床試驗評估、制劑研究和穩定性實驗中都保持恒定。
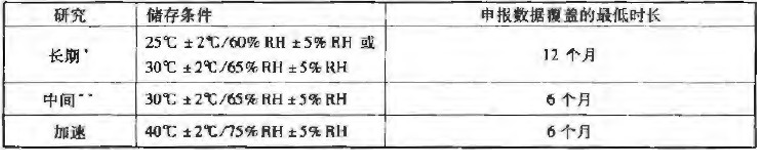
加速試驗(Accelerated testing):加速試驗是采用超出貯藏條件的試驗設計來加速原料藥或制劑的化學降解或物理變化的試驗,是正式穩定性研究的一部分。(加速試驗數據還可用于評估在非加速條件下更長時間的化學變化,以及在短期偏離標簽上注明的貯藏條件(如運輸過程中)時對質量產生的影響;但是,加速試驗結果有時不能預測物理變化。)
中間試驗或中間條件試驗:中間試驗是為擬在25℃下長期貯藏的原料藥或制劑設計的在30℃/65%RH條件下進行的試驗,目的是適當加速原料藥或制劑的化學降解或物理變化。
長期試驗:長期試驗是為確定在標簽上建議(或批準)的有效期(復檢期)進行的,在擬定貯藏條件下的穩定性研究。
注冊批次:用于正式穩定性研究的原料藥或制劑批次,其穩定性數據在注冊申報時可分別用于建立原料藥和制劑的有效期(復檢期)。原料藥申報批次均至少是中試規模;新制劑3個批次中至少2個批次是中試規模,另1個批次的規模可小一些,但必須采用有代表性的關鍵生產步驟;仿制制劑申報批次均至少是中試規模。注冊批次也可以是生產批次。
生產批次:使用申報時確認的生產廠房及生產設備,以生產規模生產的原料藥或制劑批次。
承諾批次:注冊申報時承諾的在獲得批準后開始進行或繼續完成穩定性研究的原料藥或制劑的生產規模批次。


復檢期:通常對多數已知不穩定的生物技術/生物原料藥和某些抗生素,建立確認的是有效期,而對多數較穩定的化學原料藥,建立確認的實為復檢期。復檢期是在此期間內,只要原料藥保存于規定的條件下,就認為其符合質量標準,并可用于生產相應的制劑;而在此期限后,如果用該批原料藥生產制劑,則必須進行質量符合性復檢;如復檢結果顯示其質量仍符合質量標準,則應立即使用;1批原料藥可以進行多次復檢,且每次復檢后可以使用其中的一部分,只要其質量一直符合質量標準即可。
影響因素試驗(制劑):是指為評估劇烈條件對制劑質量的影響而進行的研究。該試驗包括光穩定性試驗和對某些制劑(如:定量吸入制劑、乳膏劑、乳劑和需冷藏的水性液體制劑)的特定試驗。

- (上一篇):生物工藝一次性產品,必須擁有!
- (下一篇):Integritest5完整性測試儀測試前需要做好哪些準備工作?